栏目:生命科学 作者:佚名
图1:拟南芥PEAT复合体中各亚基的互作
HAM1/2是真核生物中保守的MYST类型的组蛋白乙酰化酶,这类组蛋白乙酰化酶在酵母及动植物中作为NuA4/TIP60复合体的核心催化亚基发挥作用。该研究发现PEAT复合体中的EPCR组分与HAM1/2直接结合,作为HAM1乙酰化酶的辅助亚基发挥作用,是HAM1在核小体上催化组蛋白H4K5乙酰化(H4K5ac)所必需。通过ChIP-seq发现,EPCR与HAM1/2在全基因组水平共同促进大量靶基因上的组蛋白H4K5ac修饰。这表明HAM1/2-EPCR在PEAT复合体中作为组蛋白乙酰化模块发挥作用,揭示了HAM1/2作为PEAT复合体亚基调控组蛋白乙酰化修饰的独特分子机制。
该研究在体外检测了UBP5的酶催化活性,发现UBP5能够去除核小体上的H2A泛素修饰,而对核小体上的H2B泛素修饰没有作用,揭示了UBP5具有特异的H2A去泛素酶活性(图2)。进一步研究发现,UBP5在拟南芥中负责去除H2A泛素修饰,在ubp5突变体中H2A泛素修饰整体水平显著上升。另外,在PEAT复合体组分中,PWWP组分的突变体表现出总体H2A泛素修饰水平上升(图2)。与此相应,PWWP也是PEAT复合体中唯一与UBP5直接结合的组分,表明UBP5-PWWP在PEAT复合体中作为H2A去泛素化模块发挥作用。利用ChIP-seq发现,PEAT复合体的组分主要富集在蛋白编码基因的转录起始点附近,在全基因组水平呈现共定位,共同介导组蛋白乙酰化及H2A去泛素化。
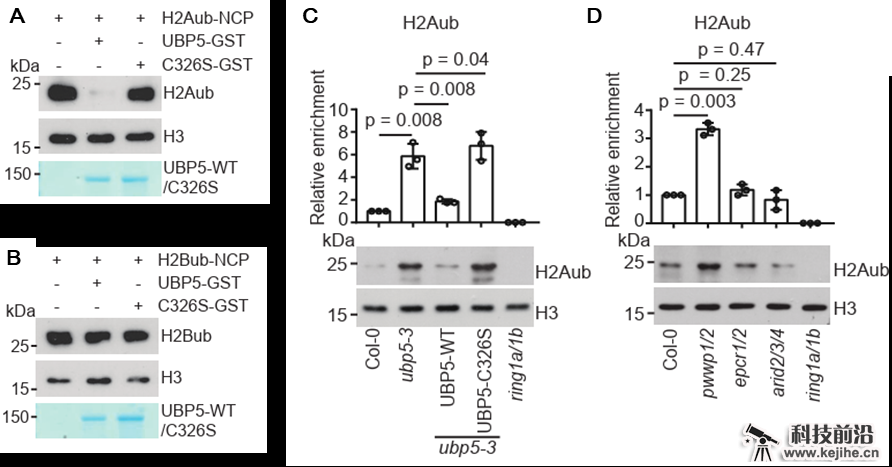
图3:PEAT复合体调控染色质修饰工作模型
北京生命科学研究所的博士生郑思遥为论文的第一作者,何新建研究员为论文的通讯作者。其余作者包括北京生命科学研究所的关彬彬、袁丹阳、赵强强、谭连美、陈姗姗、李琳、陈涉研究员以及中国科学院生物物理研究所的许瑞明研究员和葛蔚然。该研究得到了科技部、国家自然科学基金委和北京市政府的资助。
版权声明:文章观点仅代表作者观点,作为参考,不代表本站观点。部分文章来源于网络,如果网站中图片和文字侵犯了您的版权,请联系我们及时删除处理!转载本站内容,请注明转载网址、作者和出处,避免无谓的侵权纠纷。
上一篇:你了解生命科学吗?
相关推荐

